
文章信息
第一作者:梅惠娅,吴冬琴
通讯作者:吴郁 教授(江南大学公共卫生与健康研究院 现代环境毒理学研究室),刘月影 教授 (江南大学附属医院 儿科学研究团队)
通讯单位:江南大学附属医院
https://doi.org/10.1016/j.scitotenv.2023.168578
亮点
•PM2.5暴露可能会改变癫痫患者的铁代谢以及Nrf2介导的铁死亡相关通路的基因表达。
•PM2.5暴露可能会加重癫痫模型小鼠的症状,并恶化其认知功能障碍。
• 采用铁死亡抑制剂可以减轻PM2.5暴露对癫痫模型小鼠造成的神经毒性加剧
• 体外与体内的研究表明,PM2.5可能通过激活IL6/NF-κB/Nrf2/GPX4及Nrf2/FTH1通路,加剧癫痫诱导的铁死亡。
研究进展
PM2.5,即空气动力学直径≤2.5μm的大气可吸入颗粒,是空气污染物中最为关键的组分之一。由于其粒径微小、易于富集有毒物质、滞留时间较长、与细胞亲和力强等特征,PM2.5对人体健康构成严重威胁。既往研究表明,PM2.5可经呼吸道进入肺部,继而进入血液循环系统,因此与呼吸系统疾病及心血管系统疾病密切相关。近年来,随着研究的不断深入,学者们发现PM2.5可通过破坏血脑屏障、损伤嗅球等途径进入大脑,从而影响神经系统疾病,但其详细机制仍有待进一步阐明。因此,PM2.5对神经系统疾病如阿尔兹海默病、帕金森综合征、癫痫等的调控机制成为了当前研究的热点。
作为儿童最常见的慢性神经系统疾病之一,癫痫发病机制错综复杂,存在多种诱发因素,越来越多的证据表明环境污染物暴露在其中的作用不容忽视。国内一项流行病学研究表明,伴随着PM2.5浓度升高,癫痫患者的发作频率及住院率显著上升,但其具体机制尚未阐明。铁死亡(ferroptosis)是一种新发现的铁离子依赖的脂质过氧化物大量聚集引起的细胞程序性死亡,在神经系统疾病和环境污染暴露诱导产生的人体危害中扮演着重要角色。江南大学现代环境毒理学研究团队联合江南大学附属医院儿科学研究团队发现PM2.5可通过促进海马神经元发生铁死亡来加重癫痫症状及相关认知功能障碍。
研究人员首先采用GEO数据库中的PM2.5人群队列进行生物信息学分析,该分析提示PM2.5暴露可能影响铁代谢及Nrf2介导的铁死亡途径相关基因的表达。接着,通过小型人群观察队列(NCT05758129)的研究进一步表明,PM2.5暴露同样影响癫痫患儿外周血中铁死亡相关基因的表达水平。此外,通过疾病作用靶点数据库的分析揭示了PM2.5暴露对癫痫潜在作用靶点及机制的影响。进一步的动物及细胞实验确认了PM2.5暴露可加剧癫痫症状及认知功能障碍,铁代谢及Nrf2介导的铁死亡通路在此过程中起着关键作用。这项研究明确了PM2.5暴露对癫痫症状的潜在影响,为预防和控制癫痫的潜在风险因素提供了新的靶点和方向(图1)
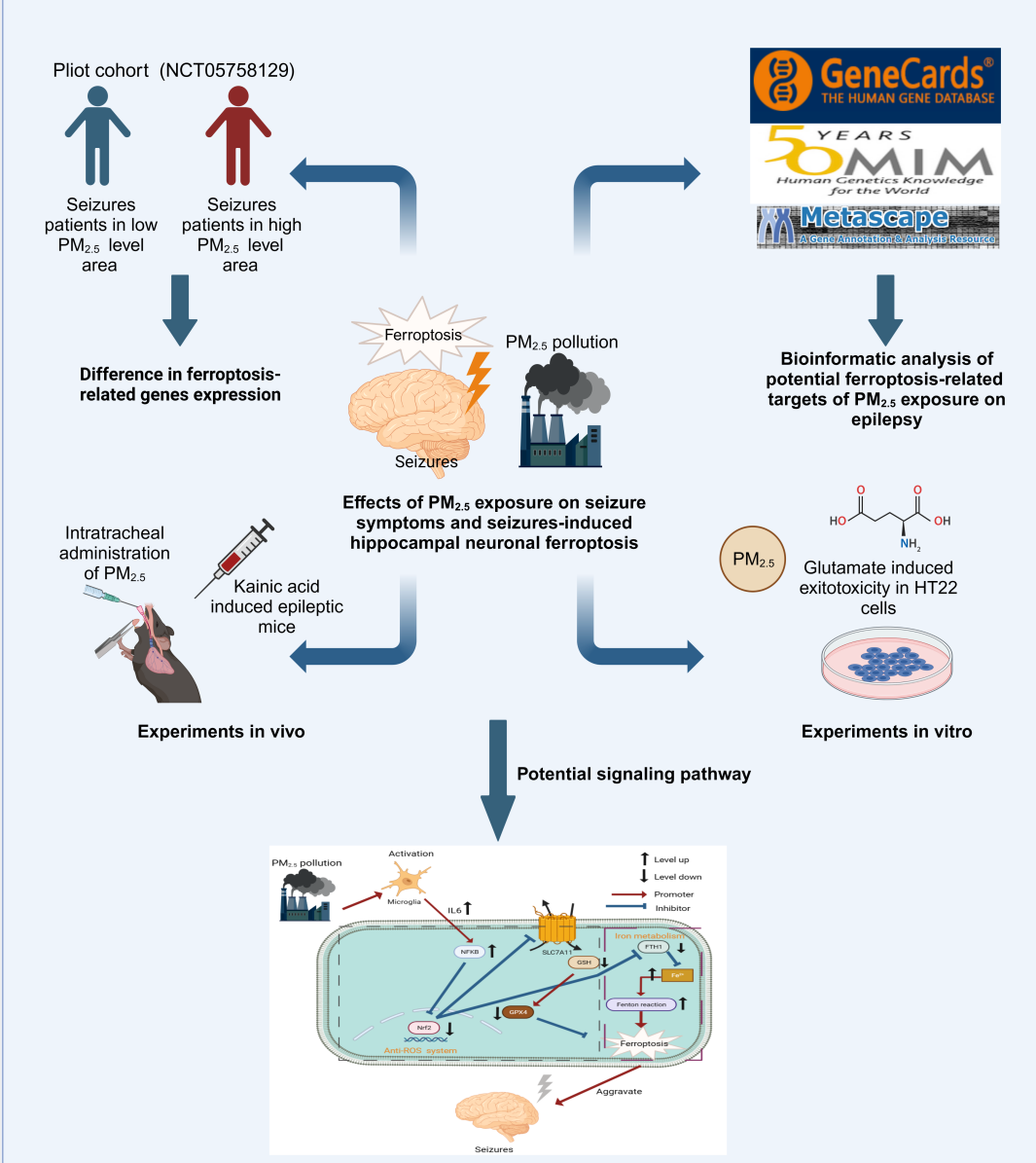 图1 图文摘要
图1 图文摘要
本研究首先分析了从GEO数据库获取的GSE60767数据集,研究捷克两个城市—高PM2.5污染的俄斯特拉发和低PM2.5污染的布拉格—的居民外周血中铁代谢和Nrf2依赖性铁死亡通路相关基因的表达情况。结果显示,在高PM2.5污染环境下,包括FTH1、Nrf2、SLC7A11和GPX4在内的关键基因的表达水平显著下降。为了进一步探究这一现象是否在癫痫患者中也存在,我们进行了小型观察性队列研究,分析了中国无锡(对照组)和徐州(PM2.5暴露组)初次诊断的癫痫患者的外周血样本。研究发现,Nrf2、SLC7A11 和GPX4的mRNA表达水平在PM2.5暴露组中也同样显著降低(见图2)。这些发现表明,PM2.5暴露可能通过调节铁代谢及Nrf2介导的铁死亡通路的相关基因表达,进而加剧癫痫症状。
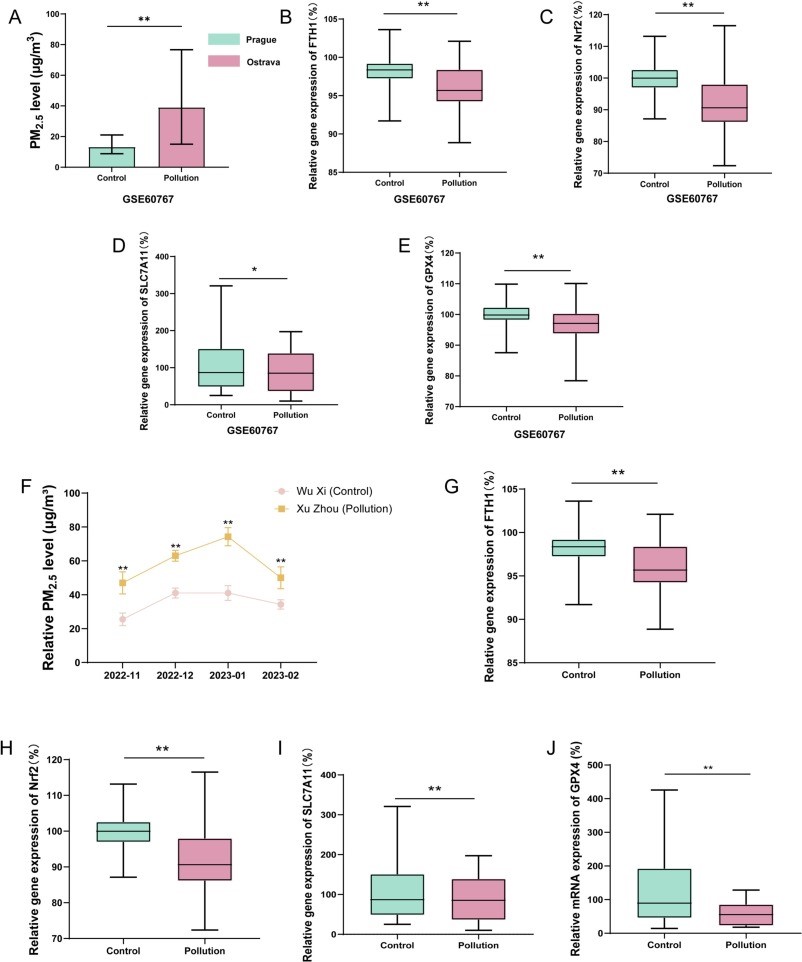
图2(A)捷克两城市的PM2.5水平;(B-E)GSE60767数据集中FTH1、Nrf2、SLC7A11和GPX4基因表达情况;(F)2022年冬季无锡(对照)及徐州(PM2.5暴露)城市PM2.5的相对水平;(G-J)癫痫患者外周血样本中FTH1、Nrf2、SLC7A11、GPX4的基因表达情况
为进一步探索PM2.5暴露对癫痫影响的潜在靶点,本研究利用了在线公共数据库进行生物信息学分析。通过将OMIM和GeneCards数据库中的癫痫相关数据集与PM2.5暴露相关数据集进行交集分析,我们探究了PM2.5暴露影响癫痫的潜在靶点基因(图3-1 A)。接着,使用Metascape数据库进行通路富集分析,GO富集分析结果显示,这些基因显著富集在炎症反应、IL-6信号通路和氧化应激反应等生物过程中(图3-1 B)。KEGG富集分析则显示基因主要富集于脂质代谢与动脉粥样硬化、坏死性凋亡及铁死亡等途径(图3-1 C)。随后, 我们通过整合FerrDb数据库筛选出调控铁死亡的关键基因,并利用蛋白互作网络结合Cytohubba分析来筛选关键的靶点基因,明确了FTH1、IL6和NFE2L2/Nrf2在调控铁死亡通路中的核心作用(图3-1 D-F)。此外,我们还使用CMAP数据库筛选潜在的治疗药物,进一步突显了神经炎症在PM2.5引发的癫痫影响中的关键角色(图3-1 G)。综合这些分析结果,本研究揭示了PM2.5可能通过促进神经炎症进而调控神经元铁死亡来加剧癫痫症状。其中,IL-6、FTH1和NFE2L2/Nrf2的调控作用尤为关键,为未来针对癫痫的治疗和预防提供了重要的分子靶点。
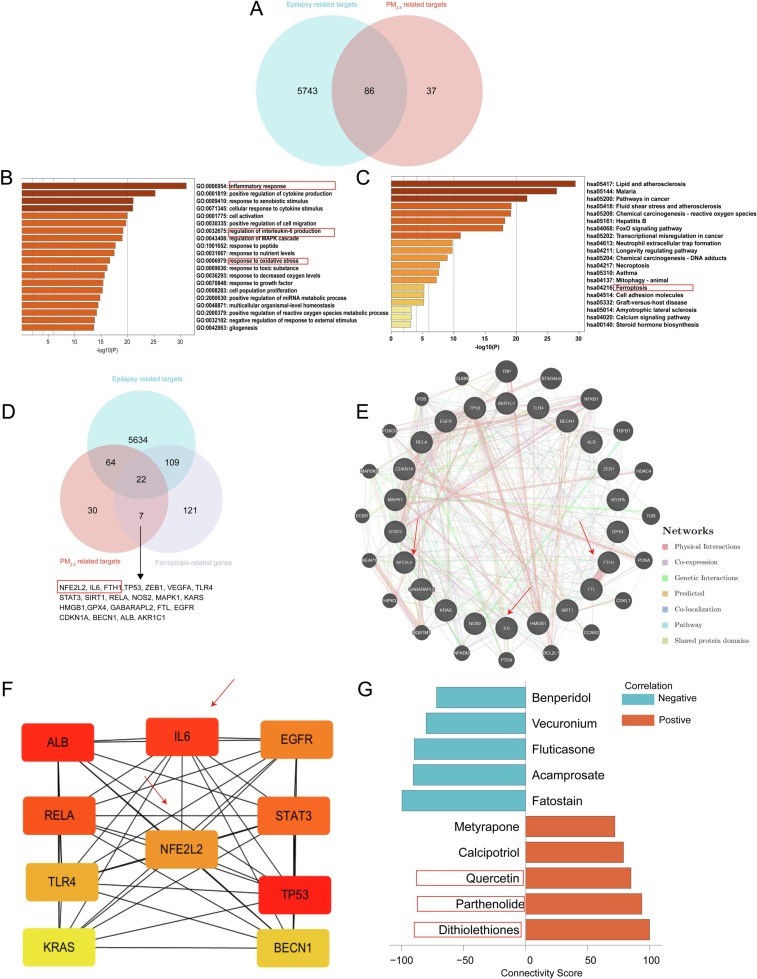
图3(A -D)PM2.5暴露与癫痫相互作用及潜在铁死亡靶点韦恩图;(B-C)GO功能富集分析和KEGG信号通路富集分析;(E、F)蛋白互作网络(PPI)及TOP10基因;(G)cMAP数据库的药物预测结果
为了进一步验证相关假设,本研究运用腹腔注射红藻氨酸的小鼠模型来进一步明确潜在的铁死亡调控通路。本研究将C57小鼠分为5组:对照组、PM2.5组、癫痫组(KA)、PM2.5+癫痫组(PM2.5+KA)、铁死亡抑制剂组(PM2.5+KA+Fer-1)(图4)。通过气管滴注PM2.5、腹腔注射Fer-1等方式预处理30天,每3天一次,期间每周记录一次体重,结果显示PM2.5暴露可影响小鼠体重增长,此改变可能与PM2.5暴露引起氧化应激及炎症导致小鼠能量消耗增加有关(图4B)。在第31天,腹腔注射红藻氨酸(KA)制备癫痫模型并观察、记录癫痫发作情况4小时。结果表明,相较于KA组,PM2.5+KA组的癫痫发作评分、癫痫发作频率和癫痫发作持续时间明显增加,而PM2.5+KA+Fer-1组则有所缓解(图4C-F)。除次之外,我们还运用了EEG脑电图直观展示了PM2.5暴露对癫痫症状的加剧效果,结果表明PM2.5+KA组在癫痫发作时脑电峰值及功率更高(图4G-J)。上述结果证明PM2.5暴露确实会加重癫痫发作症状,而抑制铁死亡后症状有所缓解。
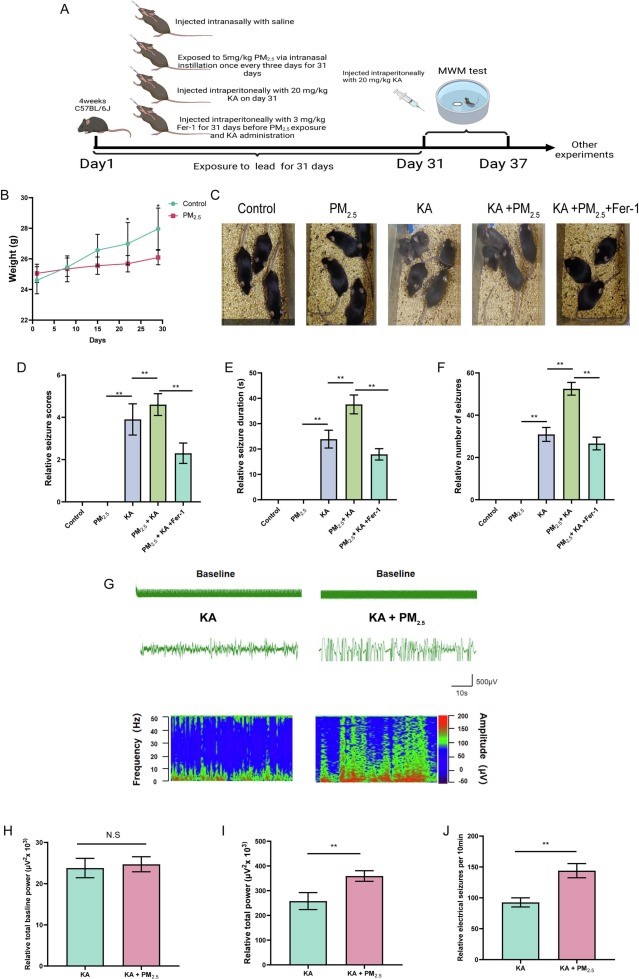
图4PM2.5暴露对小鼠癫痫症状的影响
(A)动物模型流程图;(B)PM2.5对小鼠体重影响;(C-F)不同分组癫痫造模后表现、癫痫评分、癫痫持续时间及发作次数;(G-J)不同分组小鼠脑电图表现及量化
本实验通过Morris水迷宫测试来评估小鼠的学习记忆功能。为了确保实验结果的准确性,实验开始前首先对各组小鼠的运动功能进行了测试,以排除运动功能对实验结果的潜在影响(图5A)。实验结果显示,与其他组相比,PM2.5+KA组小鼠从训练的第三天起逃避潜伏期显著延长(图5B),表明该组小鼠的学习效率较低。在实验的最后阶段,即定位航行测试中,PM2.5+KA组小鼠找到平台的次数及在平台所在象限停留的时间均明显少于其他组(图5C-E)。这些数据表明PM2.5暴露可能会加重癫痫小鼠的认知功能缺陷。而通过铁死亡抑制剂Fer-1的预处理的癫痫小鼠则能缓解PM2.5暴露加重的认知功能缺陷。这一结果提示,铁死亡路径在PM2.5暴露导致的认知功能缺陷中发挥关键作用,且其抑制可有效逆转这些认知缺陷。。
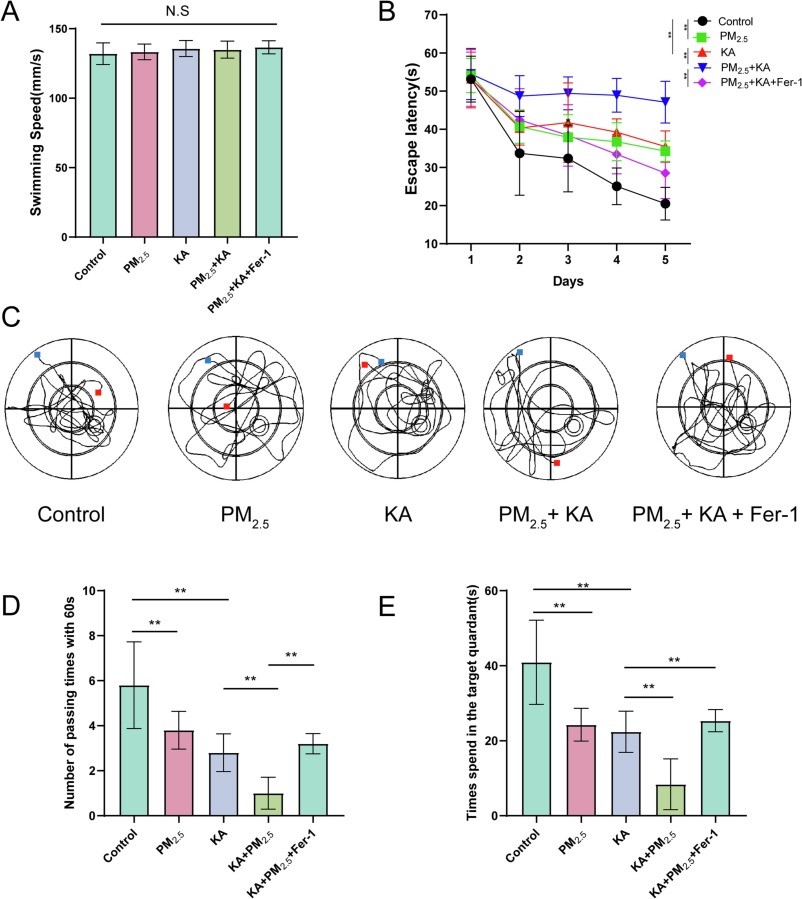
图5PM2.5暴露对KA诱导的癫痫小鼠认知功能的影响
(A)不同分组小鼠运动速度比较;(B)定位航行期的逃避潜伏期;(C-E)空间探索期小鼠运动轨迹、穿越平台次数及在目标象限的时间;
由于海马神经元在癫痫的发病过程及认知功能中发挥着极其重要的角色,本实验通过尼氏染色技术进一步探讨了PM2.5暴露对癫痫小鼠海马神经元的影响。实验结果显示,与单纯癫痫组相比,PM2.5暴露的癫痫小鼠在海马区CA1和CA3区域的神经元数量显著减少,而在齿状回(DG区)的神经元数量则与其他组无明显差异。然而,使用铁死亡抑制剂Fer-1预处理的癫痫小鼠在海马神经元缺失现象得到了显著缓解(图6A-D),这表明PM2.5暴露可能通过加剧海马神经元的铁死亡来加重癫痫症状。为了进一步验证这一机制,我们使用透射电镜(TEM)观察海马组织,发现PM2.5颗粒直接出现在海马组织中(图6E中白色箭头),这可能由于PM2.5通过诱导的神经炎症对血脑屏障的破坏所产生。此外,在海马神经元中观察到铁死亡的特征性形态,即线粒体皱缩(图6E中红色箭头),为PM2.5通过加剧癫痫小鼠海马神经元的铁死亡来加重癫痫症状提供了直接的形态学证据。
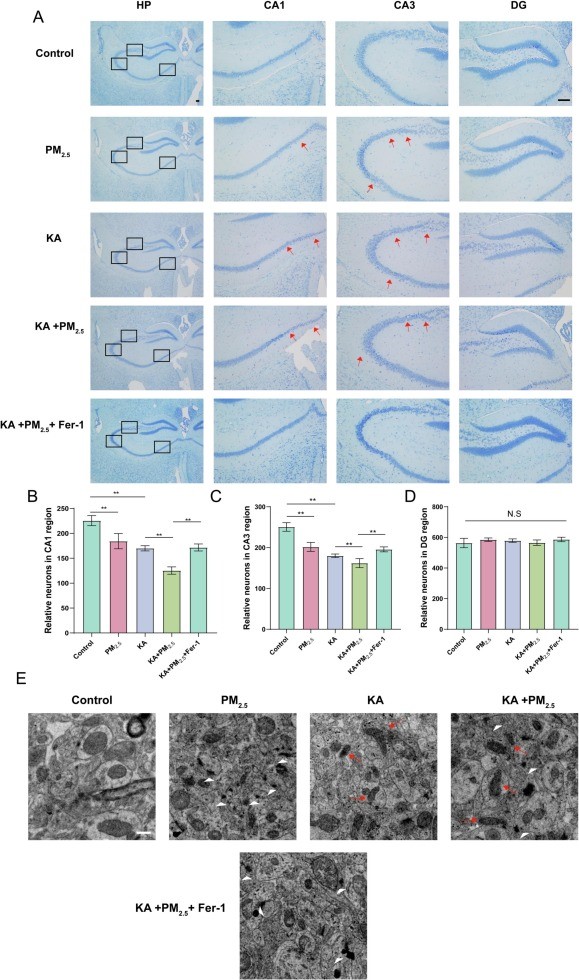
图6PM2.5暴露对小鼠海马神经元的损伤
(A)小鼠海马神经元尼氏染色;(B-D)CA1、CA3、DG区神经元数量;(E)小鼠海马神经元线粒体形态变化;
为进一步验证PM2.5暴露对癫痫小鼠海马神经元铁死亡的影响,我们在海马组织中检测了铁离子(Fe2+)的含量以及多个与铁死亡相关的生化标志物,包括丙二醛(MDA)、谷胱甘肽(GSH)、和前列腺素内过氧化酶2(PTGS2)(图7A-D)。检测结果均显示PM2.5暴露显著加剧了铁死亡的生化过程。通过Western blot技术(图7E),我们比较了不同实验组海马组织中的关键蛋白表达情况。结果显示,在PM2.5加KA处理的组别中,炎症相关蛋白IL6和磷酸化NF-κB(p-NF-κB)的表达显著上升,而与抗氧化防御和铁死亡调控相关的Nrf2、SLC7A11、FTH1和GPX4等蛋白的表达则显著降低。这些变化与我们之前从生物信息学分析中得出的预测相吻合,进一步支持了PM2.5通过影响这些关键蛋白表达来加剧铁死亡和癫痫症状的假设。
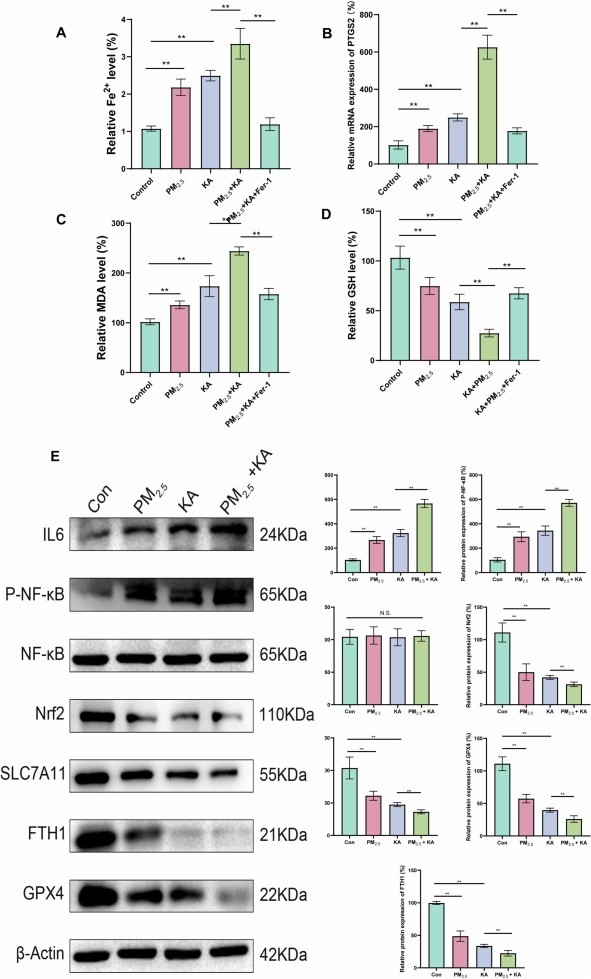
图7 PM2.5暴露加重癫痫小鼠海马神经元铁死亡
(A-D)组织铁含量、PTGS2的mRNA表达、MDA、GSH含量等铁死亡指标;(E)海马组织中IL6、p-NF-κB、NF-κB、Nrf2、SLC7A11、FTH1和GPX4的蛋白表达
在细胞实验中,我们运用小胶质细胞BV2与海马神经元HT-22细胞,以探究PM2.5暴露是否通过诱导神经炎症来加剧海马神经元的铁死亡。我们采用了CCK-8实验来评估海马神经元的活性。实验结果(图8A-B)显示,PM2.5显著降低了HT-22细胞的活性,从而对海马神经元造成损伤。当加入Nrf2抑制剂(ML385)或GPX4抑制剂(RSL3)时,上述细胞损伤表现得更为严重;反之,当使用铁死亡抑制剂(Fer-1)时,这些损伤得到了明显的缓解。这些发现提示,PM2.5暴露可能通过激活Nrf2和GPX4介导的铁死亡途径,加重海马神经元的损伤。此外,铁死亡抑制剂的应用能有效抑制这种损伤,提示铁死亡途径在PM2.5引起的神经毒性中扮演关键角色。
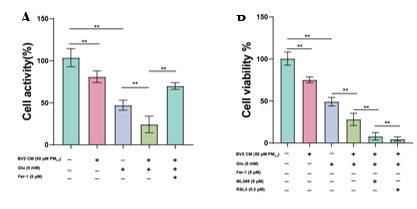
图8PM2.5暴露对Glu诱导的体外细胞模型的神经毒性作用
为进一步验证PM2.5暴露是否通过调控铁死亡通路来影响癫痫,我们在细胞实验中对癫痫细胞模型的海马神经元进行了一系列的生化检测。具体实验包括测定MDA(丙二醛)含量(图9A)、GSH(谷胱甘肽)含量(图9B)、PTGS2(前列腺素内过氧化酶2)的mRNA表达(图9C)、细胞内二价铁离子含量(图9D)以及脂质过氧化水平(图9E)。实验结果均表明,PM2.5暴露显著加剧了海马神经元的铁死亡,这与我们的动物实验结果是一致的。
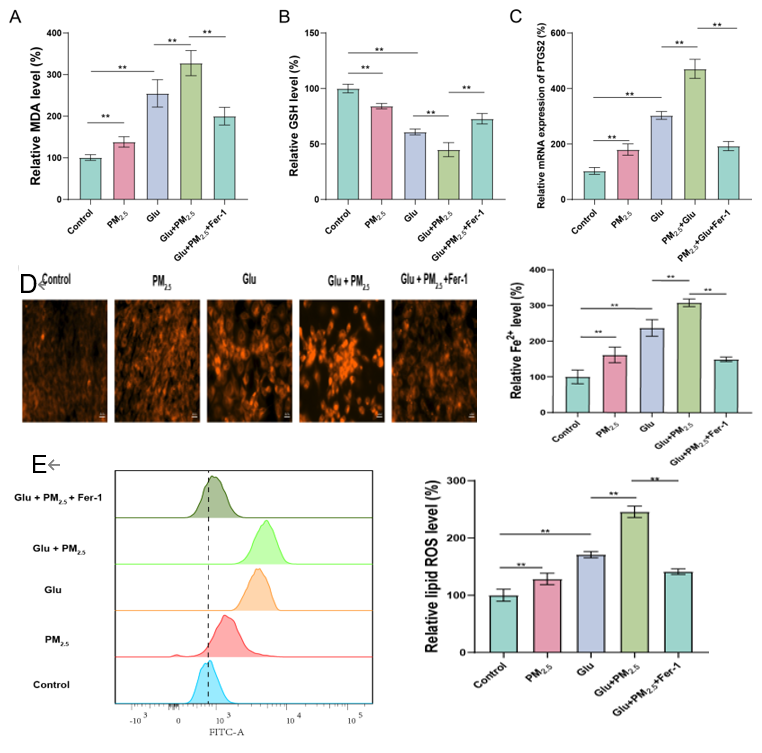
图9 PM2.5暴露加重癫痫体外细胞模型发生铁死亡
(A-C)MDA含量、GSH含量、PTGS2的mRNA表达水平;(D)细胞内铁离子含量(FerroOrange);(E)细胞脂质过氧化水平(Lipid-ROS)
细胞免疫荧光试验明确显示了PM2.5对铁死亡关键蛋白GPX4的影响,表现为其在细胞中的表达显著降低(图10A)。此外,WB实验结果显示,PM2.5暴露会导致海马神经元中炎症相关蛋白IL6和磷酸化NF-κB(p-NF-κB)的表达显著升高,而抗氧化与铁死亡调控蛋白Nrf2、SLC7A11、FTH1以及GPX4的表达显著降低。
结合前期的动物实验及生物信息学结果,这些发现表明IL-6/NF-κB/Nrf2/GPX4和Nrf2/FTH1途径可能是PM2.5通过诱导神经炎症进而促进神经元铁死亡的潜在通路。
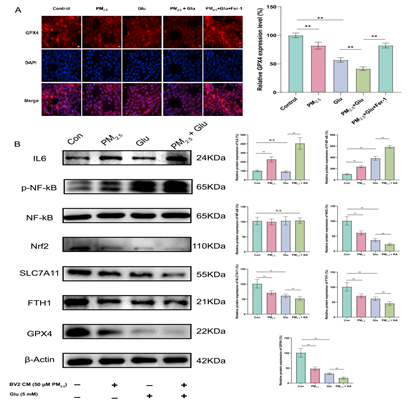
图10IL-6 / NF-κB / Nrf2 / GPX4和Nrf2 / FTH1可能是PM2.5促进神经元铁死亡的潜在通路
(A)GPX4免疫荧光图;(B)IL6、p-NF-κB、NF-κB、Nrf2、SLC7A11、FTH1和GPX4的蛋白表达;
本研究结合人群样本、动物模型及细胞模型,从多角度阐明了PM2.5暴露对癫痫的影响,证明了PM2.5暴露可加重癫痫症状及相关认知功能障碍,并进一步明确了铁死亡相关通路在PM2.5暴露影响癫痫中的重要性,为癫痫的防治提供了新的角度与方向。